Іржа – ворог номер один майже будь-якого металу. «Руда чума», що з завидним упертістю та постійністю перетворює сотні тисяч тонн блискучої високосортної, високоміцної, легованої сталі на купи коричневого порошку. Хвороба, для якої не існує перешкод… Але існують ліки і від неї: гальванічні покриття, лаки та фарби, бітуми та мастики – всі вони в принципі повинні захистити метал. Але насправді все не так просто.
Дуже гостро проблема захисту від корозії стоїть, наприклад, перед автомобілістами. Загальновідомо, що якщо не вживати певних заходів, то кузов автомобіля протягом чотирьох-п’яти років може перетворитися буквально на іржаве решето. Часто не допомагають ні лаків’яні покриття, ні мастики, оскільки кузов має чимало закритих порожнин, пазух, кишень, коробів, в яких дорожній бруд і сирість, замішані на кухонній солі, створюють чудові умови для електрохімічної корозії. А при сучасній товщині автомобільного сталевого листа це призводить до дуже швидкого його виходу з ладу.
Але від корозії можна не тільки захищатися бронею з лаку або хрому, її можна й обдурити, підсунувши у вигляді приманки такий ласощі, як метал з більш високим електродним потенціалом.
Електродний потенціал? А яке він, власне, має відношення до корозії металів? Виявляється, найбезпосередніше.
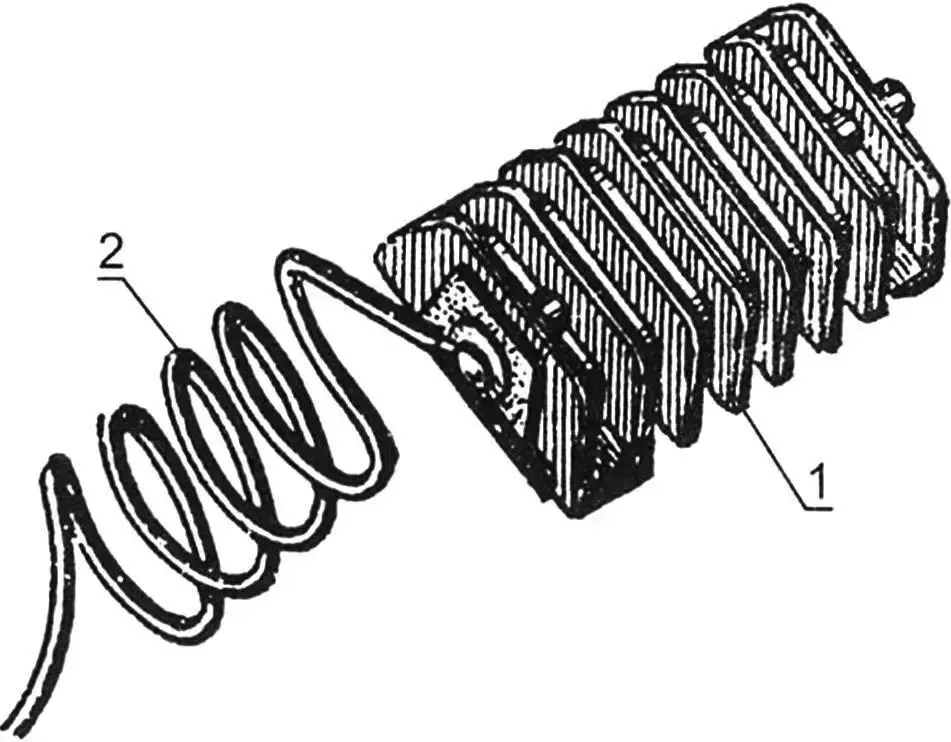
1 – ребристий цинковий електрод; 2 – з’єднувальний провід
Якщо опустити в посудину з електролітом два електрично пов’язаних між собою металевих електроди, то один з них почне розчинятися, інший же залишиться недоторканим. Так ось, виявляється, розчиняється метал, електродний потенціал якого вищий. Ця властивість гальванічної пари і дала можливість використовувати ефект збереження катода для запобігання електрохімічній корозії кузова автомобіля.
Суднобудівники давно вже використовують цей принцип запобігання внутрішній частині трюму від корозії – вони розміщують всередині корпусу спеціальні металеві аноди (з металу з більш високим електродним потенціалом, ніж у металу корпусу). Цей спосіб взяли на озброєння і автомобілісти.
Для анодного захисту застосовують ребристі (для збільшення поверхні) шматки цинку. За допомогою вбудованих у них постійних магнітів вони прикріплюються в найбільш важкодоступних і забруднюваних місцях кузова. Електричний зв’язок здійснюється багатожильним проводом: за допомогою гвинтів цинковий анод підключається до кузова.
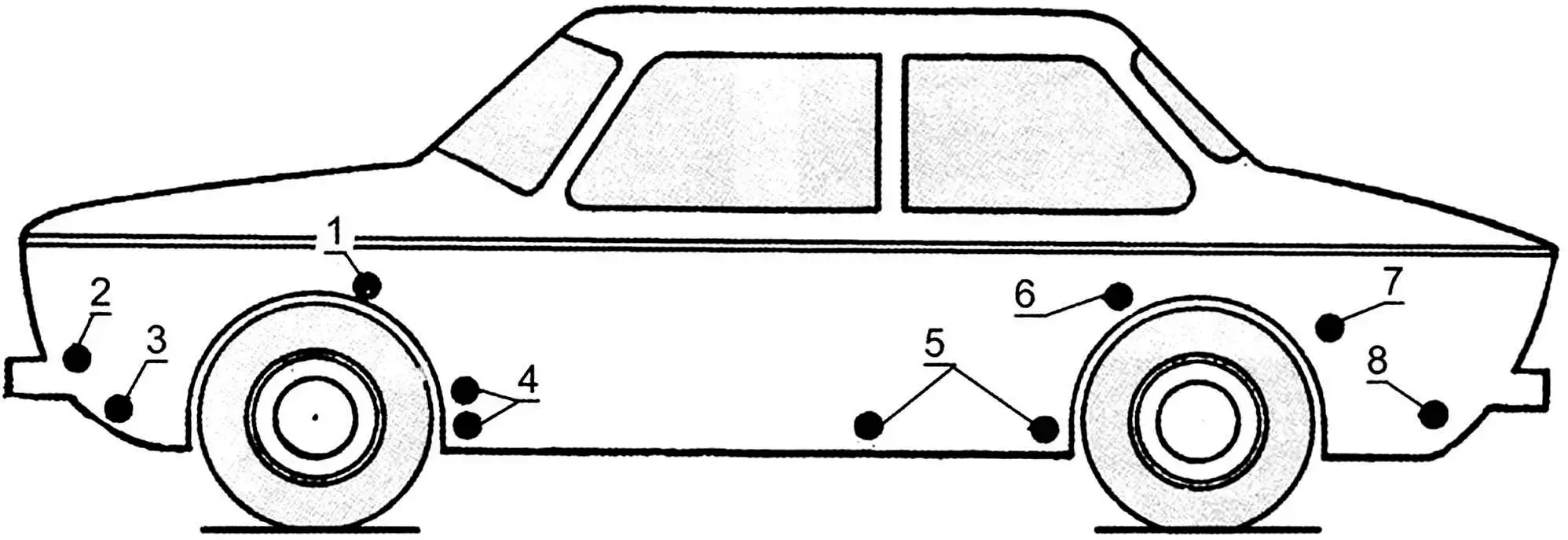
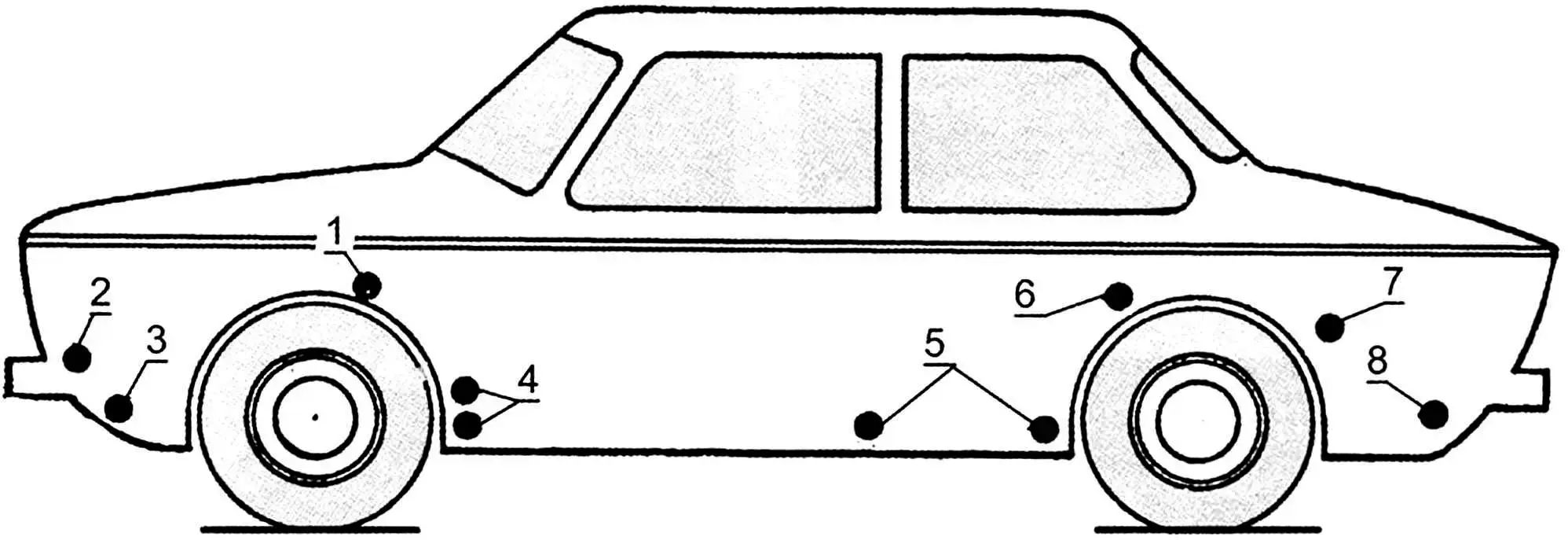
1 – коробчасті підсилювачі бризговиків; 2 – місця кріплення корпусів фар і підфарників; 3 – нижня частина передньої панелі; 4 – порожнини за щитками-підсилювачами передніх крил; 5 – внутрішні поверхні дверей; 6, 7 – передня нижня частина заднього крила і арка колеса по стику з крилом; 8 – фартук задньої панелі
На його ребрах збирається дорожній бруд, волога, кухонна сіль, і комплект «цинк – сталь» починає працювати так, як працює всім відомий гальванічний елемент. При роботі такої «батареї» відбувається розчинення цинкового анода, катод у даному випадку не витрачається.
Процес корозії нагадує роботу гальванічного елемента, оскільки сталь являє собою в основному сплав заліза і вуглецю, тобто речовин з різними електродними потенціалами. При потраплянні на поверхню такого сплаву електроліту між зернами заліза і вуглецю починає йти електрохімічна реакція, що супроводжується розчиненням анода (заліза) і переходом його в гідрати, а потім і в оксиди.
Присутність же електрично пов’язаного з основним металом цинкового електрода в корені змінює картину. По відношенню як до заліза, так і до вуглецю цинк являє собою метал з більш високим електродним потенціалом, тобто виступає в ролі анода. Тому при наявності електропровідної середовища, яка практично завжди присутня на поверхнях автомобільного кузова, електрохімічна реакція йде з розчиненням анода (цинку), при збереженні катода, тобто металу кузова.
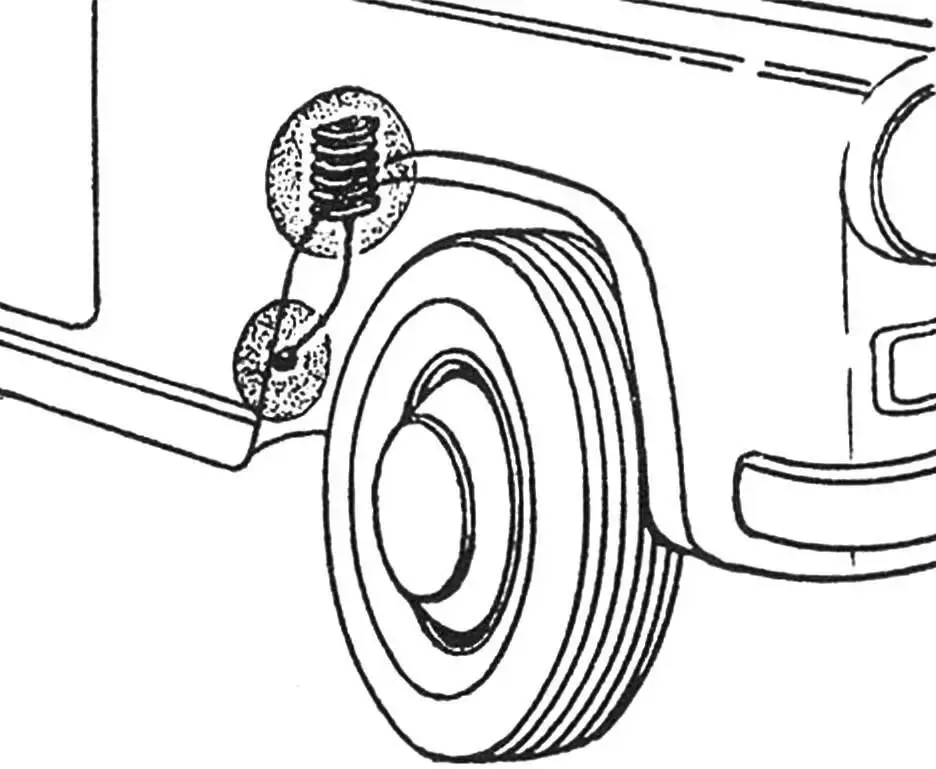
Як показали експерименти, цинкового електрода величиною з сірникову коробку вистачає на 3 – 5 років.
Обдуріть «руду чуму». Підсуньте їй приманку – шматочок металу з електродним потенціалом вищим, ніж у сталі. Корозія охоче вчепиться в нього, забувши про кузов вашого автомобіля як мінімум на три роки.
(За матеріалами журналу «Teknik for alla», Швеція)